


错配修复需要分辨新旧链——甲基化- -旧
5‘→3'/ 3'→5' 核酸外切酶 —— 修复
识别后剪开错配的子链
通过切除修复中两种方式内任意一种进行切除后重新复制


碱基切除修复 (Base Excision Repair, BER)
核酸切除修复(Nucleotide excision repair, NER)
由于碱基的不稳定所造成的的碱基化学损伤,以及辐射引发的胸腺嘧啶二聚体,可以经过核苷酸切除修复系统而修复(大肠杆菌中是Uvr修复)。另外非复制期的碱基化学损伤,还有糖基化酶修复系统,这是一种碱基切除修复。

HR和NHEJ是双链断裂(DSB)后的修复方式。区别是HR需要有同源的模板,而NHEJ不需要模板。最近常用的CRISPR/Cas系统ko基因的方式就是利用了NHEJ的特点。
先复制再修复,即复制后修复 —— 损伤可能一直存在,随子代增加,比例减少
①受损伤的DNA链复制时,产生的子代DNA在损伤的对应部位出现缺口
②完整的另一条母链DNA与有缺口的子链DNA重组交换,将母链DNA上相应片段填补子链缺口处,母链DNA出现缺口。
③以另一条子链DNA为模板,经DNA聚合酶催化合成一新DNA片段填补母链DNA的缺口,最后由DNA连接酶连接,完成修补。
——损伤被修复,切除修复
SOS 修复(SOS repair)也称差错倾向修复(error prone repair),是细胞中的DNA 受到大规模损伤,严重影响其生存,在其他修复难以见效的情况下,被诱发出来的一种高效修复系统,这种修复是为了保命也就管不了修补的片段是否正确,这也是生物为了维持其生命的延续,不得已采取的一种以牺牲遗传物质的忠实性,冒着产生大量基因突变风险的“保命”措施。表现特点
①细胞内原有的修复酶(切除修复、重组修复)合成量增加
② 诱导产生的修复酶(SOS聚合酶)来修复损伤部位

SOS反应:细胞DNA受到严重损伤或DNA复制系统受到抑制的紧急状态下,为求生存而出现的应急反应,包括生长抑制、分裂停止、呼吸受阻、整合在宿主基因组上的原噬菌体释放、细胞正常生长发育的许多基因关闭,同时有一些应激状态下的新基因开放等,这些基因使机体DNA损伤得以高效修复,细菌又可逐渐回复到正常状态
SOS反应诱导产生一整套特殊DNA聚合酶──DNA聚合酶IV和V,它们不具有校对活性,可以催化空缺部位DNA合成,这时补上去的核苷酸几乎是随机的,却保持了DNA完整性,使细胞得以生存。但这种修复带给细胞很高的突变率。
对原核生物它产生高变异,对高等动物则是致癌的。
SOS反应由Rec A蛋白和Lex A阻遏物相互作用引起。Rec A蛋白激活Lex A自身的蛋白水解酶活性,自我分解。
微同源介导末端连接 (Microhomology-mediated end joining, MMEJ)
这种修复方式相当于是NHEJ的替代方式,在NHEJ未激活时细胞用这种方式修复DNA双链损伤。NHEJ过程中所需的蛋白Ku70-Ku80以及Rad1可以抑制MMEJ路径,当这些蛋白不再与DNA损伤部位结合时,MMEJ路径被激活,此时MRX复合物、Sae2以及Exo1通过核酸酶作用从5'至3'端切除损伤部分的序列,然后暴露出微同源序列。双链上的微同源序列互相结合,随后经过剪切修饰以及连接得到无损的DNA双链。这种情况下得到的DNA双链相比于原来的双链,微同源序列5'端被核酸酶剪掉的那段序列就缺失了。
当微同源序列之间结合不够稳定的情况下,DNA聚合酶可通过将3'端的互补序列延申,如果新得到的序列能跟原本的微同源序列稳定的结合,那么二者结合后就通过同样的剪切修饰和连接得到无损的DNA双链,然而在这种情况下得到的DNA双链,与原双链相比,缺少了一开始被核酸酶切掉的那部分,同时插入了TLS聚合酶延申的那部分序列。可见MMEJ这种修复方式是极易发生突变的。
因为现在研究发现主要是Polθ对这一路径进行修复,原因可能是Polθ能够在同源性很低(比如只有5~6个碱基配对)的情况下合成DNA,有一些文章里也把这一路径叫做TMEJ (polymerase Theta-Mediated End Joining)
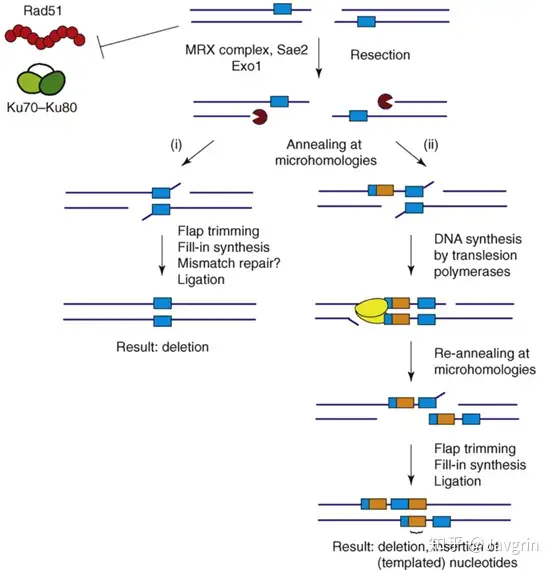
(图片来源:doi:10.1016/j.tig.2008.08.007)
夸损伤合成(TLS)