上面介绍的这个方法报道得比较早,因此也被研究者广泛使用,但是这个方法还有很多可以改进的地方。首先,可以将λ-Red重组系统放到质粒上表达,这样既能增加表达量,又方便用于不同的宿主。其次,质粒消除系统可以改进一下,利用Cas9-sgRNA切割高拷贝的psgRNA质粒难以切割干净,平板上得到的单菌落仍然需要验证Amp抗性。

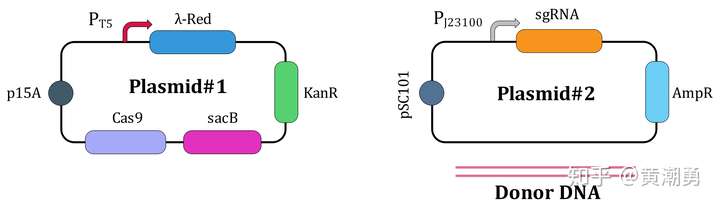
图2所示是我构建的基因组编辑系统,这个系统也是一个双质粒系统,为了方便描述,我把这两个质粒分别称为Plasmid#1和Plasmid#2。用双质粒系统的好处是可以把固定不动的组件放在其中一个质粒上(比如这里的Plasmid#1),把每次编辑都需要变动的组件放到另一个质粒上(比如这里的Plasmid#2),这样的话,每次编辑时只需要构建一个小的质粒就可以了。
如,Plasmid#1用来搭载固定不动的组件——Cas9表达元件和重组酶表达元件,Plasmid#2用来搭载sgRNA表达元件。
在质粒消除系统上,我也做了一点改进,我在Plasmid#2上使用低拷贝温敏型复制子pSC101,每一轮编辑之后,只要将阳性克隆放在37℃中培养就可以很快除去这个质粒,再引入新的Plasmid#2进来,进行新一轮编辑;我在Plasmid#1上放了一个sacB基因,含有这个基因的细胞对蔗糖敏感,所以每次最后一轮编辑完成之后,只要将阳性克隆在无抗条件下培养一段时间,再将菌液稀释涂布在含有蔗糖的平板上,长出来的菌落就已经丢失了Plasmid#1。