
Cre-Loxp系统在使用过程当中,技术上也可能存在各种各样的问题,从而造成部分假阴性或假阳性的结果,或者严重干扰了细胞本身的内源命运决定机制。

很多Cre,比如Cd19-Cre, 是替代了基因组中原有基因的位置;还有一些Cre,比如Foxp3-Cre, 是插入了内源基因的3’UTR 的位置。这两点有可能造成Cre插入事件对于内源基因表达造成显著影响,例如有些基因的杂合子和纯合子表达基因量不同导致下游信号强度差异,或者影响很多基因在表达后3’UTR端的基因修饰。此外,还有一些Cre是由细菌人工基因组(BAC)整段整合进入的,理论上包括多数顺式的基因调控序列。但是现在基因组学对于远端调控原件的认知逐步加深,该方案并不能完美替代内源基因序列对该“模拟基因序列-Cre”的真实调控,因此很多时候并不能作为条件敲除的合理方案。
Cre重组酶的重组效率并不是100%的,也就是说当Cre小鼠与flox小鼠交配后,特定组织中只有部分细胞中发生重组,因此会产生嵌合模式。
lox位点的放置位置会影响重组效率。只有两个lox位点相遇才能在Cre作用下发生位点特异性重组,而两个lox位点相距越远,它们相遇的概率就越低,导致重组效率也就越低。因此,在设计条件性基因打靶策略时,需要考虑基因结构与flox区域的长度,来降低重组失败的风险。
作者们此处提出的问题无法完全被避免,但在Cre后面整合一个荧光蛋白,可以真实的指示Cre是否正确表达于特定细胞谱系中,从而避免对假阳性结果的误读。
Cre的表达量并不等同于Cre对lox位点的重组效率。很多时候由于基因组调控的复杂性,以及每个基因在不同细胞内染色质状态不同,Cre对于不同基因位点的Loxp切割效率并不一致。
甚至有可能会出现同一种Cre小鼠对一种flox基因起作用,对另一种flox基因则不起作用的极端情况。研究者们往往在Rosa26位点插入“前中断报告基因(Loxp-Stop-Loxp-Reporter, LSL-R)”,用于指示Cre的效率。而在使用Reporter小鼠指示Cre活性时,由于Reporter小鼠中lox位点与报告基因所在的基因组状态偏开放,从而使得Cre在Reporter小鼠中重组的效率会比对实际目标lox位点的重组效率要高一些。因此,Reporter小鼠验证的结果可以作为一种参考,但不是金标准。可以用多种不同的Reporter小鼠来检测Cre小鼠的特异性重组,反映出Cre重组酶对不同基因的重组效率可能是不同的。
作者们对此也提出了部分解决方案,重点是在Cre作用之后,和对照组比,测量到底有多少Cre-Loxp的靶标基因位缺失或者蛋白下降,而这个最好在单细胞层面上进行具体测量。同时,也可以检测靶标基因的直接下游,间接地估计Cre的效率。
使用细胞特异性启动子控制Cre的表达可实现目标基因的选择性失活、激活或突变。通常我们希望Cre重组酶受启动子限制,仅在小鼠的部分细胞中发挥重组作用。但Cre的意外表达,或被称为**“异位”表达仍时常发生,这些异位表达可能会导致一些我们不希望发生的重组。因此在建立Cre小鼠时选择谱系标志基因很重要。高特异性的谱系标志基因能高效精确地表达Cre,降低Cre漏表达或异位表达的概率。**应尽量避免使用那些高表达但非特异的标志基因来构建Cre小鼠。
很多Cre的启动基因是根据条件高表达基因进行筛选的。对于像Cd19这种非常谱系特异的启动基因,Cre的工作效率高并且不会“漏”到其他相关的细胞谱系当中。然而,很多相对特异性偏弱的条件启动基因,往往会存在“漏”Cre信号进入其他相关细胞谱系的问题,尤其对于一些生命周期比较短的细胞(如中性粒细胞),往往会造成“漏”的Cre-Loxp切割导致了部分细胞亚群重塑的结果,进而影响对下一步靶基因功能的正确解读。
在使用Reporter小鼠验证组织特异性GeneX-Cre小鼠时,由于对GeneX本身表达谱的研究并不详尽,GeneX可能在生殖细胞或早期胚胎发育过程中存在瞬时表达,因此常常会发现报告基因的表达比预期的更为广泛。想要明确是否发生了生殖系中的Cre意外表达,可以通过**将不同性别的子代小鼠(GeneXCre/wt;Reporterlox/wt)分别与野生型小鼠交配获得第二代。如果这些二代小鼠中报告基因的表达较第一代子代更为广泛,那么很有可能发生了Cre的生殖系表达。**因为Cre介导的重组可能发生在配子形成的二倍体阶段,发生重组后的单倍体子细胞发育成胚胎,导致第二代子代小鼠即使没有Cre基因的整合,仍表达报告基因。
如果Cre小鼠发生了生殖系表达,那么在应用该Cre小鼠进行条件性基因打靶时,需要谨慎选择Cre小鼠的性别与交配方式以及对照组。比如,母系遗传的Cre小鼠品系,需要使用雄性带有Cre整合的小鼠进行繁殖;而父系遗传的Cre品系,则需要用雌性Cre阳性小鼠来繁育。当然,也可以通过使用诱导型Cre小鼠解决Cre生殖系意外表达的问题,实现仅在成年或胚胎发育晚期激活Cre重组活性,获得条件性基因打靶小鼠。
作者们提出,对于并不完全的谱系标记物(例如只是高表达),最好不使用这个基因作为Cre的启动基因。同时,对于新建立的谱系,应该利用PCR等方案,确定其临近或者类似细胞谱系中,不存在严重的Cre遗漏信号。
在细胞快速扩增时期诱导Cre-Loxp系统工作可能会存在着显著的细胞毒性。

利用Tamoxifen诱导Cre-ERT2进入细胞核,从而实现诱导的条件敲除,是免疫学研究中的常见手段。但是该系统对细胞分化和增殖有什么影响则很少有报道。Wherry组观测到,在LCMV感染模型中,非诱导条件敲除的Cre (E8i-Cre) 不会显著影响T细胞在效应细胞期的生存, 而在感染后利用Tamoxifen诱导的组中则会出现显著的T细胞数量下降 (图1A-1C) 。同时,研究者们也观察到,纯合子的Cre-ERT2比杂合子的Cre-ERT2有更高的细胞毒性 (图1B-1C) 。Wherry组进一步研究发现,在感染前进行Tamoxifen处理带有Cre-ERT2的细胞,并不会影响T细胞在感染后的数量。
因此,对于诱导表达的Cre, 研究者应当注意Tamoxifen处理的时间,以及处理的阶段对于细胞数量的影响。
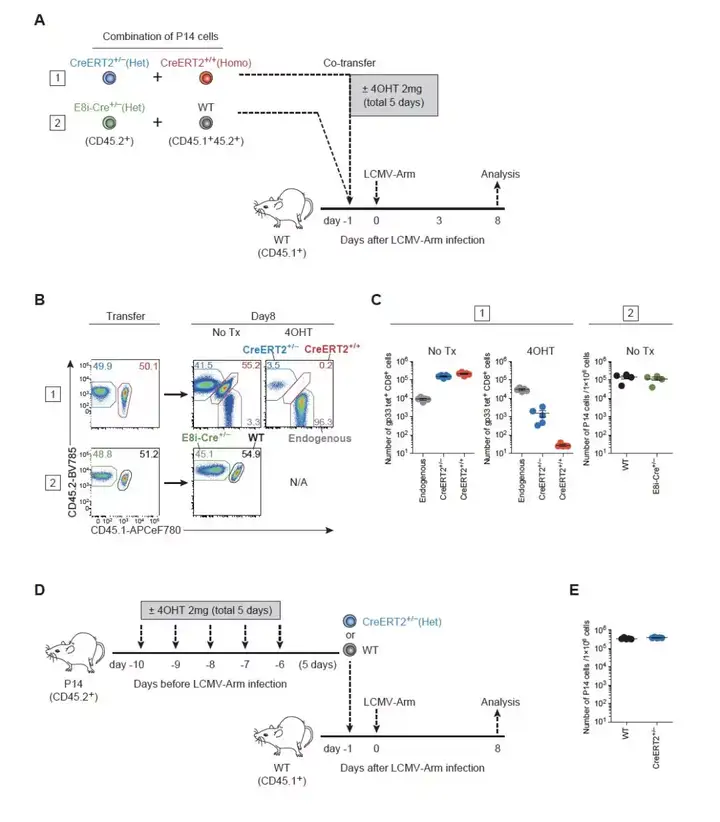
图1. 诱导条件表达Cre对于T细胞数量的影响。

最后,Lu教授总结说,不存在完美的模型和完美的解决方案,但我们需要清楚的认识到每一个遗传模型的问题,才可以更好的解释我们的实验结果。
