真核生物的细胞核中含有3种RNA聚合酶,RNA Pol I 和Pol III 主要合成核糖体RNA和tRNA,RNA Pol II 合成编码RNA(mRNA)和非编码RNA(ncRNA),ncRNA包含小核/小核仁RNA(small nuclear/nucleolar RNA,sn/snoRNA),小RNA (microRNA, miRNA),以及广义的长链非编码RNA(lncRNA)。我们最关心的就是Pol II 的转录产物。
转录开始后,生成的不同RNA产物往往有不同的命运,编码RNA大部分被输送到细胞之中,相反,许多ncRNAs留在核中最终被降解。新生的RNA会发生加5’端帽、内含子去除以及3’端形成等过程,在这个过程中,RNA始终受到核酸外切酶的威胁,最终成功输出到胞质中被降解,RNA命运决定的机制就存在于整个加工过程中。
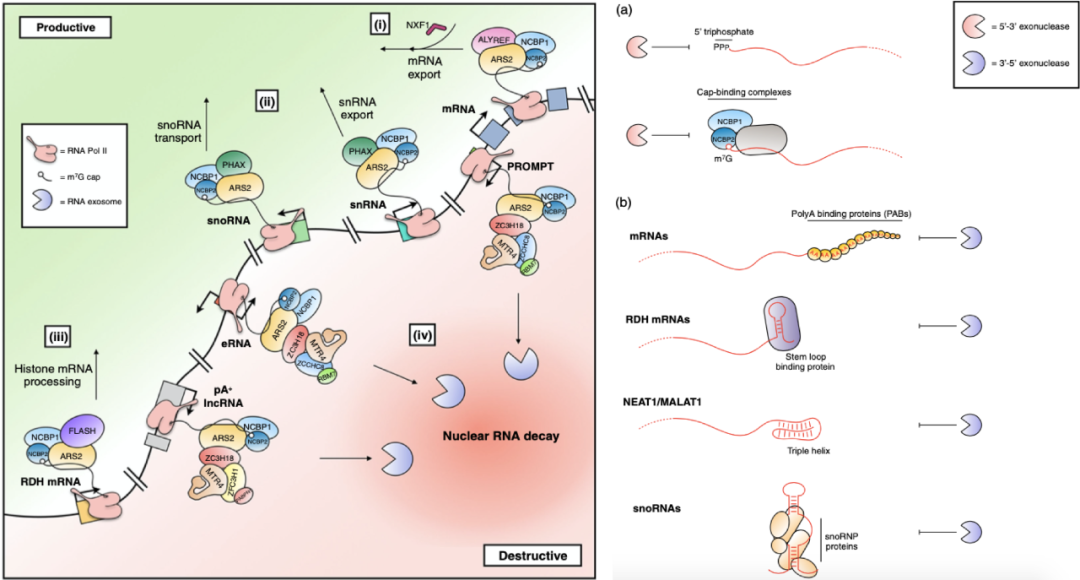
5’端m7G帽的加入是RNA命运决定的第一步。其一,m7G帽可以防止新生RNA被5’-3’核酸外切酶降解;其二,m7G帽会招募可以跟它结合的CBC,并通过CBC结合其它下游蛋白,通过结合相应的因子,使pre-mRNA和snRNA/snoRNA分配至各自相应的出核定位通路(productive方向);也可以通过结合另一些因子,使PROMOPTs、eRNA、部分sn/snoRNA、lncRNA等留在核内并最终降解(destructive方向)。(图1)

图1 RNA的命运(左) 图2 5’与3’端的保护机制(右)
剪切过程也对RNA有影响,剪接通常发生在Pol-II转录的延长期,在此过程中剪接体直接与许多输出因子相互作用,促进了出核的过程。RNA加工的最后一步是3’末端的形成和pol II 转录的终止。RNA3’末端加工影响核糖核蛋白(RNP)复合物的形成,从而影响转录物的命运。
所有的RNA加工途径都不断受到5’和3’核酸外切酶的威胁,末端修饰(如5’端修饰及3’端特殊结构形成)或者与RNA结合蛋白(RBPs)结合可以保护转录产物免受核酸外切酶影响,从而促进其在核内的稳定性。没有保护的RNA片段,例如剪切下来的内含子等,即可被外切酶降解从而保证RNA加工过程的质量控制。(图2)
除此之外,为了在细胞核中继续存活,一些RNA被隔离成为RNP聚集体,称为nuclear speckles和paraspeckles, 以逃脱降解的命运。还有一些RNA,通过自身的某些区域与染色质相结合来逃避降解。(图3)
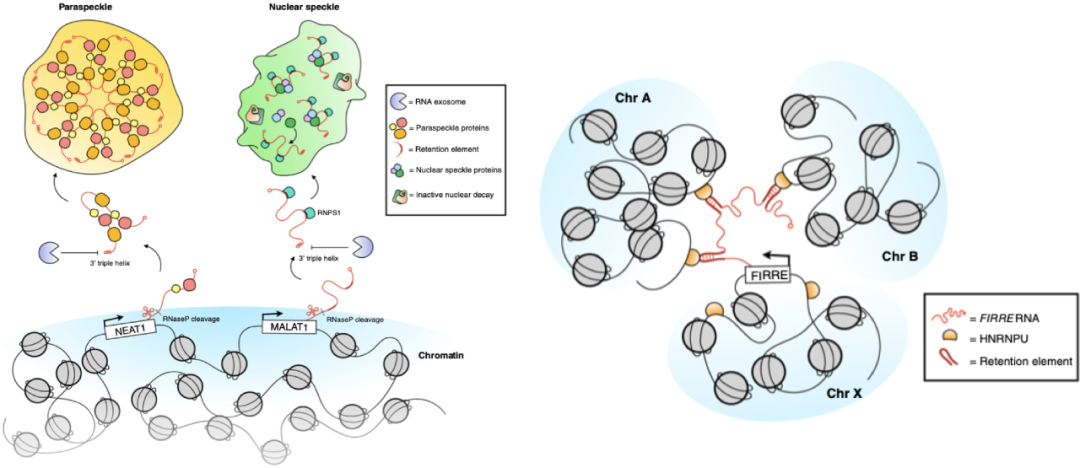
图3 RNA通过隔离在亚核区域或与染色质相结合逃避降解
近年来,研究工作已经开始揭示RNA的核分类机制,以及哪些成分有助于区分RNA是随后出核到胞质中还是靶向降解。所有Pol-II转录本都可以作为降解的靶点,但是高效的加工、快速的输出和/或保护性的元素可能有助于转录本免于降解。事实上,降解可以被认为是RNA的默认状态,这是一场逃避这种命运的艰苦斗争。虽然看上去是一种浪费,但从长远来看,从进化的时间衡量,它确保了只有高质量的RNA能够生存下来,从而保持了转录组的稳定和可操作性
[1] Garland W, Jensen TH. Nuclear sorting of RNA. Wiley interdiscip rev RNA. 2020 mar; 11(2): e1572.
[2] Schmid M, Jensen TH. Controlling nuclear RNA levels.Nat Rev Genet . 2018 Aug; 19(8): 518-529